Planificar l'evolució humana.
La vida lleva 4.000 millones de años despuntando, medrando y bregando para resistir a la catástrofe, venciendo los lastres del pasado e imaginando los futuros posibles, aventurándose y sobreviviendo. Pero en toda la historia del planeta nunca había ocurrido esto: que una criatura de la evolución tome las riendas de su propio destino biológico. Parece increíble, pero los científicos creen que ya hemos alcanzado ese punto, y que por tanto no tenemos más remedio que ponernos a pensar –con toda la profundidad que esté a nuestro humilde alcance— en el abismo conceptual que se abre ante nosotros. Podemos considerarnos afortunados, al menos como testigos de la historia a escala cósmica.
La gran novedad no puede tener una denominación más decepcionante: crisp, el nombre inglés de las patatas fritas de bolsa. En realidad son unas siglas –las entenderemos más abajo— que designan una nueva técnica para modificar los genomas, una técnica tan simple, barata y eficaz que pone por primera vez a nuestro alcance la posibilidad de reescribir el código genético humano: en las células enfermas del cuerpo, sí, pero también en los óvulos y espermatozoides que determinan el destino de nuestros hijos, de los hijos de nuestros hijos y de todo el linaje que emergerá de ellos. Un pasaporte al futuro.
El fin de usar esta técnica sería curar enfermedades genéticas en la línea germinal, es decir, no ya en el propio enfermo, sino en sus hijos y el resto de su descendencia futura
Los científicos más directamente implicados en este avance se reunieron el 24 de enero en el Foro IGI de Bioética, en Napa, California, organizado por la Innovative Genomics Initiative (IGI) de la Universidad de California (en sus sedes de Berkeley y San Francisco). Su objetivo no era tanto confirmar las inmensas posibilidades de la nueva tecnología de modificación genómica –todos ellos las tenían ya muy claras— como examinar con espíritu autocrítico sus riesgos y desarrollos imprevistos, en un intento de poder atajarlos ahora que están a tiempo. El premio Nobel David Baltimore y otra veintena de investigadores presentan en Science las conclusiones de la reunión.
“La promesa de la llamada ‘medicina de precisión’ viene impulsada por la sinergia entre dos poderosas tecnologías”, explican Baltimore y sus colegas. La primera es bien conocida: el exponencial desarrollo y abaratamiento de la secuenciación (lectura) de ADN, que ha aportado ya la mayo parte de la información esencial sobre los cambios genéticos que estimulan el desarrollo de las enfermedades. La segunda es crisp.
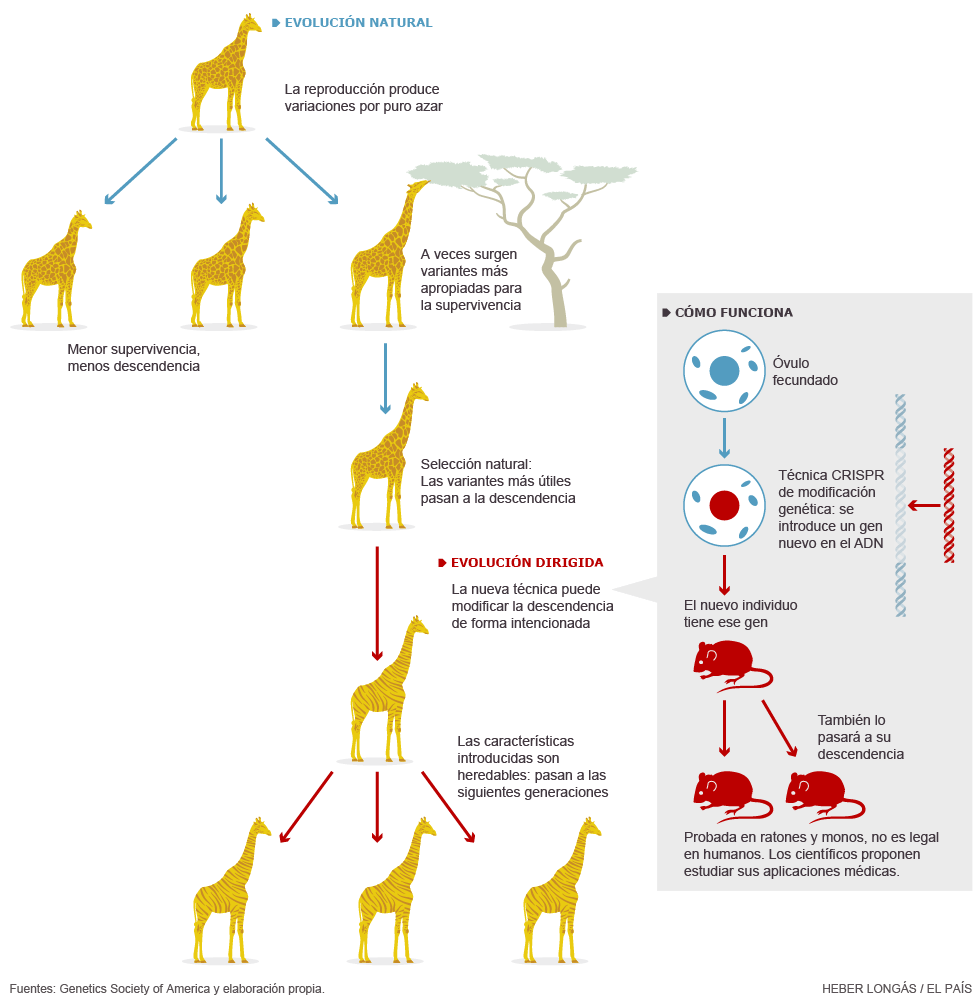
Crisp son las siglas de clustered regularly interspaced short palindromic repeats, cuya traducción no ayuda mucho: cortas repeticiones palindrómicas agrupadas y espaciadas regularmente. Se trata de una secuencia de ADN bacteriano muy especial, con tramos cortos que se repiten a intervalos regulares y que se leen igual aunque tengan la orientación invertida (es decir, palíndromos, comoreconocer o sometemos, pero en el lenguaje del ADN).
Estas secuencias se comportan en la naturaleza como verdaderos nanoingenieros genéticos: son capaces de incorporar genes extraños, como los de un virus, y de someterles luego a una variedad de servidumbres, como activarlos, reprimirlos o introducirlos en otro lugar del genoma. Las bacterias utilizan crisp como un sistema de defensa contra virus: integran sus genes y los utilizan contra el propio agente invasor. Pero los genetistas han aprendido a usar crispcomo un vehículo para sustituir, corregir o modificar el genoma de cualquier animal.
El método ha sido probado con éxito en ratones y monos, y por tanto los científicos creen que es hora de estudiar si tiene utilidad médica para los humanos
El método crisp ha sido probado con éxito en ratones y monos, y por tanto los científicos creen que es hora de estudiar si tiene utilidad médica para los humanos. En concreto, para curar enfermedades genéticas en la línea germinal, es decir, no ya en el propio enfermo, sino en sus hijos y el resto de su descendencia futura. De momento, esto es ilegal en todos los países que han regulado la embriología humana, que son todos los que tienen la capacidad técnica necesaria. Baltimore y sus colegas creen que es hora de debatir los aspectos éticos y legales para promover las reformas legales pertinentes. O para no hacerlo, si se decide que los riesgos no compensan a los beneficios.
El premio Nobel y los demás expertos son explícitos en sus recomendaciones: asegurar que los experimentos no se intenten en algún país con regulaciones demasiado laxas; discutir en foros científicos, bioéticos y gubernamentales las implicaciones sociales, éticas y ambientales; promover la transparencia del debate y la información pública “sobre esta nueva era de la biología humana”; acordar internacionalmente un grupo representativo de expertos en genética, industria, derecho y bioética.
“La confianza pública en la ciencia”, aseguran Baltimore y sus colegas, “requiere transparencia en tiempo real y discusión abierta”. Que se siga ese consejo sería también una importante novedad.
Javier Sampedro, El hombre decide su destino, El Paús, 22/03/2015
Las mitocondrias primero
J. S.
La gran mayoría de las enfermedades hereditarias se deben a mutaciones en el genoma nuclear –el situado en el núcleo de cada célula—, y los proyectos para corregirlas, aunque ya sean técnicamente posibles, deben superar aún un dificultoso proceso para demostrar su seguridad y garantizar su legalidad. Los primeros progresos en la modificación genética de la línea germinal afectarán probablemente a un hermano menor del genoma nuclear, el pequeño ADN situado en las mitocondrias, las factorías energéticas de las células, que se transmitesolo por vía materna.
“Un argumento a favor de modificar el genoma mitocondrial es que para estas enfermedades no hay una buena alternativa, explica Juan Carlos Izpisúa, del Instituto Salk de California, uno de los principales investigadores que está promoviendo esta técnica. Con las enfermedades del genoma nuclear existe actualmente la posibilidad del diagnóstico preimplantacional: generar una docena de embriones por fecundación in vitro, analizar su ADN e implantar solo los que estén libres de la mutación. Pero, mientras que el genoma nuclear es único, en cada célula hay cientos o miles de mitocondrias, unas mutantes y otras no, lo que hace inviable ese tipo de diagnóstico.
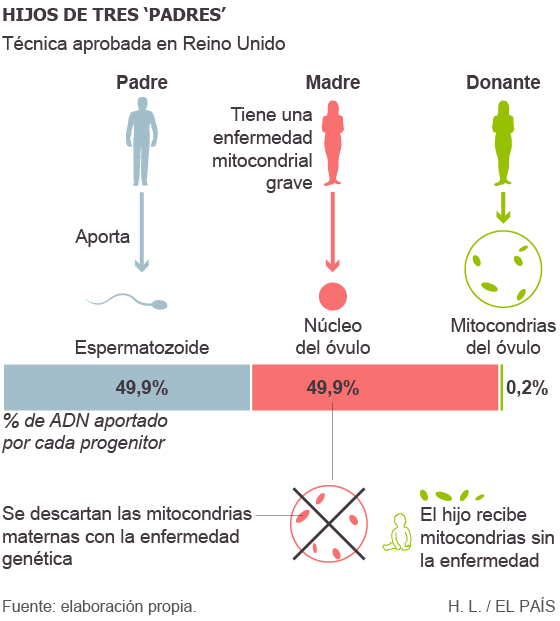
Hay otra alternativa aprobada hace muy poco en el Reino Unido, conocida popularmente como los “hijos de tres padres”. Consiste en sustituir las mitocondrias enfermas de un óvulo por las de una donante sana, y después fecundar el óvulo con un espermatozoide (total: tres progenitores). Pero en este caso el genoma mitocondrial y la mitad materna del nuclear provienen de personas distintas, y hay evidencias en ratones de que pueden ser incompatibles y conducir a efectos indeseados en el feto.
El crisp y otras técnicas relacionadas son capaces de corregir las mutaciones mitocondriales en el óvulo (o en el óvulo fecundado), y esto evitaría todos los problemas anteriores. Pese al precedente (relativo) del Reino Unido, probar la validez de esta técnica en humanos requiere algunas modificaciones legales en la mayoría de los países. Izpisúa ha tanteado al Ministerio de Sanidad español, sin ningún éxito. Los experimentos se llevarán a cabo en Estados Unidos, donde es posible crear embriones con fines de investigación, siempre que no se utilicen fondos públicos.



Comentaris